El objetivo primordial de la nomenclatura química es proporcionar una metodología rigurosa para asignar nombres y fórmulas a las sustancias de manera que puedan identificarse sin ambigüedad. Este rol recae en la Unión Internacional de Química Pura y Aplicada (IUPAC), que elabora las normas y recomendaciones. Existen tres sistemas principales de nomenclatura para los compuestos inorgánicos, cada uno con un enfoque diferente para reflejar la composición o la valencia.

Objetivos y Sistemas de Nomenclatura
Nomenclatura Tradicional
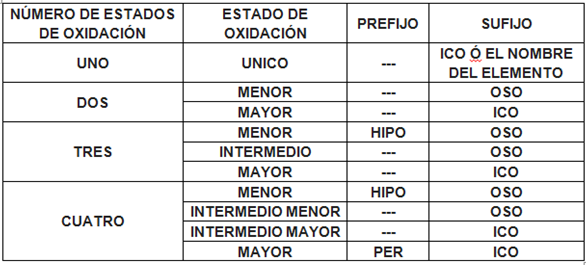
Este sistema, basado en la valencia o número de oxidación, utiliza prefijos y sufijos aplicados a la raíz del nombre del elemento. Es un sistema descriptivo, pero puede generar ambigüedad cuando se trata de elementos con múltiples estados de oxidación, lo que subraya la necesidad de sistemas más estructurales.
La estructura de las terminaciones depende del número de estados de oxidación que posea el elemento:
Nomenclatura de Stock
Este sistema es más claro, ya que indica el número de oxidación, utilizando números romanos y entre paréntesis, al final del nombre del elemento. Si el elemento posee un número de oxidación único, la indicación en números romanos se omite. Ejemplo: óxido de hierro (III) para Fe_2O_3.

Nomenclatura Sistemática
Este sistema se enfoca en la composición atómica, utilizando prefijos multiplicadores griegos para indicar el número de átomos de cada elemento presente. Los prefijos utilizados son mono (1), di (2), tri (3), tetra (4), etc., y la lectura se realiza de derecha a izquierda. El prefijo mono- del primer compuesto puede omitirse. Ejemplo: Cl_2O_5 se nombra pentaóxido de dicloro.
Nomenclatura de Compuestos Binarios
Los compuestos binarios están formados por solo dos elementos.
Óxidos
Resultan de la combinación del oxígeno con cualquier otro elemento. Los óxidos metálicos (básicos) y los óxidos no metálicos (ácidos o anhídridos) se nombran en los tres sistemas.
Ejemplo: El Fe_2O_3 (hierro con valencia +3) se llama óxido de hierro (III) en Stock y óxido férrico en Tradicional.
Peróxidos
Se caracterizan por el grupo O_2-2. El ejemplo más conocido es el peróxido de hidrógeno (H_2O_2), conocido comercialmente como agua oxigenada.
Hidruros y Halogenuros
Los Hidruros Metálicos combinan el hidrógeno (con N.O. -1) con un metal. Ejemplo: NaH es el hidruro de sodio. Los Hidruros Volátiles combinan H (+1) con no metales de grupos específicos (IIIA, IVA, VA). Ejemplos: NH_3 (amoniaco) o SiH_4 (silano).
Los Hidrácidos se forman por la combinación de hidrógeno (+1) con no metales de los grupos 16 y 17. En solución acuosa, se utiliza la nomenclatura tradicional, con la terminación -hídrico. Por ejemplo, el H_2 se llama ácido sulfhídrico.
Las Sales Binarias son combinaciones de un metal y un no metal. Se nombran utilizando el sufijo -uro para el no metal y luego el nombre del metal (ej: Cloruro de calcio, CaCl_2).
Nomenclatura de Compuestos Ternarios y Cuaternarios
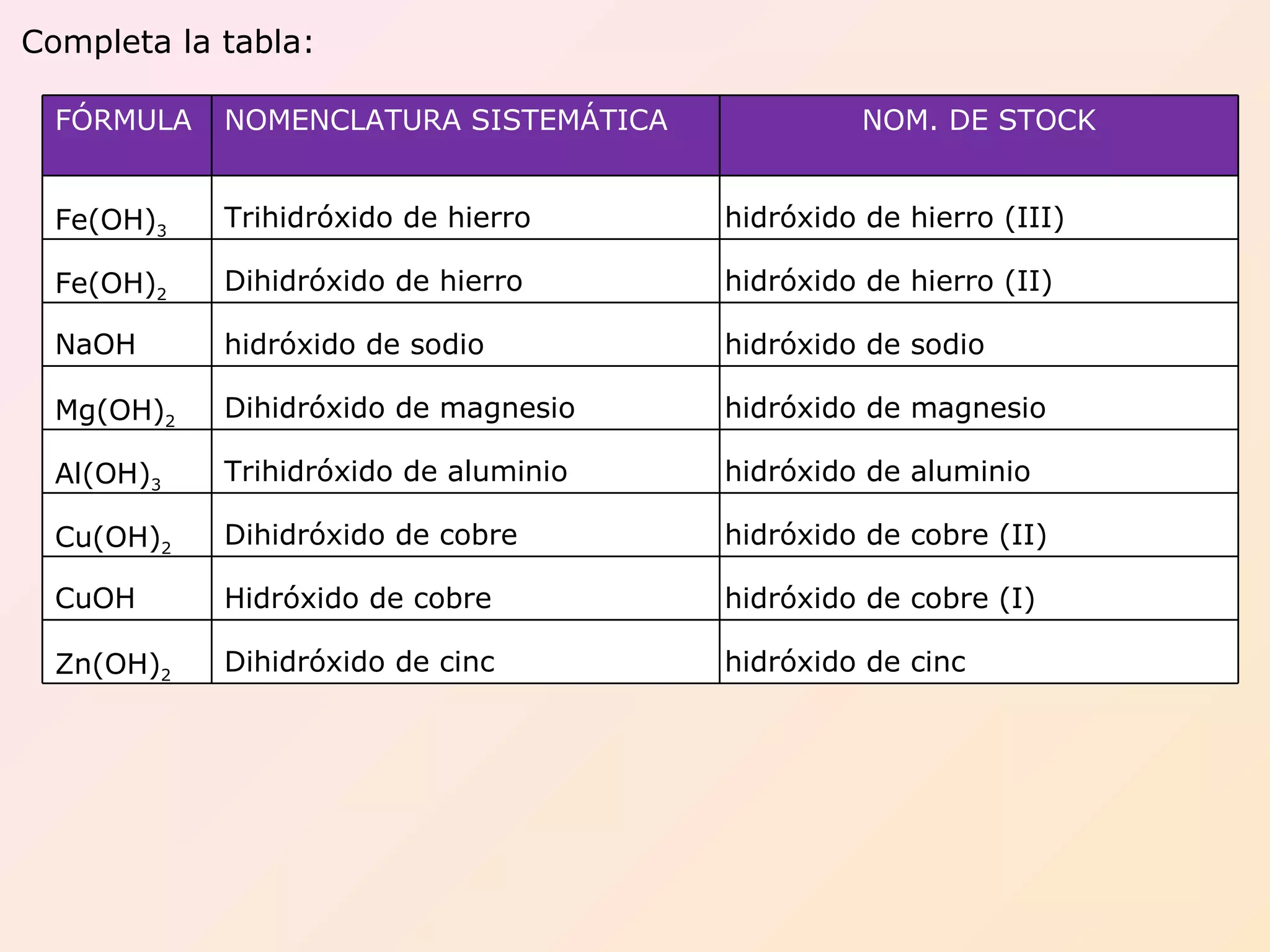
Hidróxidos (Bases)
Son compuestos ternarios que contienen el grupo hidroxilo (OH–). Ejemplos clave son el NaOH (hidróxido de sodio) y el Co(OH)_3 (hidróxido de cobalto (III)). Generalmente se nombran usando la nomenclatura de Stock.
Oxiácidos
Se forman a partir de un óxido no metálico (anhídrido) más agua. Su nomenclatura tradicional sigue las reglas hipo-oso a per-ico, basándose en el estado de oxidación del no metal central. Ejemplo: H_2SO_4 es el ácido sulfúrico.
Oxisales (Sales Ternarias)
Se derivan de los oxiácidos al sustituir los hidrógenos ácidos por un metal o catión. La nomenclatura tradicional de la sal se basa en el ácido del que proviene, sustituyendo el sufijo -oso por -ito y el sufijo -ico por -ato.
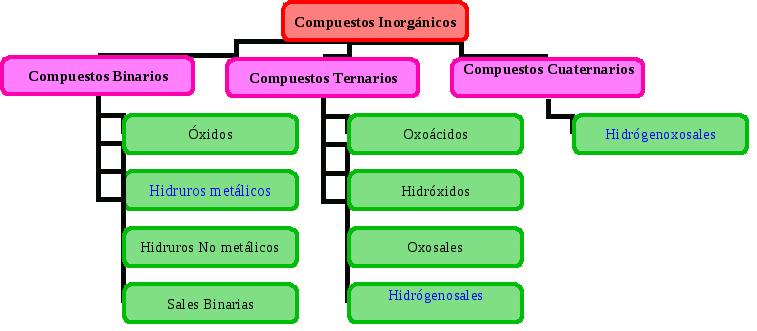
Sales Ácidas y Básicas (Compuestos Cuaternarios)
Estos compuestos contienen cuatro elementos diferentes. Las Sales Básicas contienen grupos hidroxilo (OH–) y las Sales Ácidas contienen al menos un hidrógeno ácido (H+) sin sustituir. Por ejemplo, el MgNO_3(OH) es un nitrato básico de magnesio. El conocimiento de la nomenclatura es, por lo tanto, un prerrequisito para la comprensión de la reactividad, ya que el número de oxidación (la valencia) que se usa para nombrar un compuesto es la misma que rige su potencial electroquímico en una reacción.
