Las reacciones químicas inorgánicas se clasifican generalmente en cuatro tipos fundamentales basados en la reestructuración de los reactivos y productos.

Tipos de Reacciones
Reacciones de Síntesis o Combinación:
Mecanismo: Dos o más reactivos simples se combinan para formar un producto más complejo: A + B=AB.
Ejemplo Industrial: La producción de hipoclorito de sodio (NaOCl).
Reacciones de Descomposición:
Mecanismo: Un compuesto se descompone o rompe en dos o más sustancias puras más sencillas, que pueden ser elementos o compuestos: AB=A + B.
Ejemplo: La liberación de oxígeno a partir de peróxido de hidrógeno (H_2O_2).
Reacciones de Sustitución Simple o Reemplazo Único:
Mecanismo: Un elemento reemplaza a otro dentro de un compuesto, generalmente desplazando a un elemento menos reactivo: A+BC=AC + B.
Ejemplo: La restauración o recuperación de plata.
Reacciones de Sustitución Doble o Doble Desplazamiento:
Mecanismo: Ocurre un intercambio mutuo de especies catiónicas o aniónicas entre dos compuestos, resultando en dos nuevos productos: AB + CD=AD + CB.
Ejemplo: El ablandamiento del agua.

Reacciones de Doble Sustitución Especializadas
Dentro de las reacciones de doble desplazamiento, dos subtipos son de especial relevancia en la química inorgánica:
Reacciones de Neutralización (Ácido-Base): Una reacción de doble sustitución en la que un ácido reacciona con una base, generalmente produciendo agua y una sal. Esta reacción es fundamentalmente un intercambio iónico. Un ejemplo clásico es la reacción entre el ácido clorhídrico (HCl) y el hidróxido de sodio (NaOH). La neutralización no es solo un tipo de doble sustitución, sino una de las reacciones más importantes para el análisis volumétrico y la regulación de pH.
Reacciones de Precipitación: Son reacciones, a menudo de doble sustitución, en las que uno de los productos formados es insoluble y se separa de la solución como un sólido (precipitado).

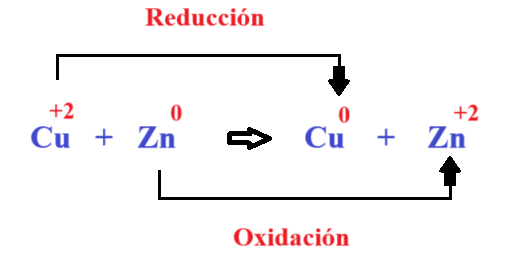
Reacciones de Óxido-Reducción (Redox)
Las reacciones Redox constituyen una clasificación transversal a las cuatro categorías anteriores, definidas por el cambio en los números de oxidación.
Fundamento: Son procesos en los que una especie química pierde electrones (oxidación) y simultáneamente, otra especie gana esos electrones (reducción). La capacidad de nombrar correctamente un compuesto, usando su número de oxidación, es un indicador de la comprensión de su potencial electroquímico, que es lo que rige si se oxidará o se reducirá.
Identificación: El uso de los números de oxidación es la herramienta clave para identificar qué átomos se oxidan (aumentan su N.O.) y cuáles se reducen (disminuyen su N.O.).
Aplicaciones: Estas reacciones son esenciales en la generación de energía, como en las plantas eléctricas donde se utilizan para mover grandes motores.