El concepto de ácido y base ha evolucionado a través de diversas teorías que han ampliado su alcance, desde las soluciones acuosas hasta los sistemas no protónicos.
Evolución de las Teorías Ácido-Base
La teoría de Brønsted-Lowry introdujo el concepto de pares conjugados: cuando un ácido dona un protón, se convierte en su base conjugada, y cuando una base acepta un protón, se convierte en su ácido conjugado. Por ejemplo, en la autoionización del agua, el agua puede actuar como ácido o base (sustancia anfótera o anfolito).
La teoría de Lewis ofrece el marco más general, siendo esencial en la química inorgánica de coordinación. Permite clasificar como ácidos a especies que carecen de hidrógeno, como el trifluoruro de boro (BF3), que es capaz de aceptar un par de electrones no enlazados donados por una base (como el amoníaco, NH3) para formar un enlace químico.

Clasificación: Ácidos y Bases Fuertes vs. Débiles
La distinción entre fuertes y débiles se basa en el grado de ionización o disociación de la sustancia en solución.
Ácidos y Bases Fuertes: Se disocian completamente en solución acuosa, liberando la máxima cantidad de iones. La reacción de ionización es unidireccional y, debido a la disociación total, no se establece un equilibrio químico y, por lo tanto, no tienen constante de equilibrio (Ka o Kb). Ejemplos de ácidos fuertes incluyen el ácido clorhídrico (HCl), el ácido nítrico (HNO3), el ácido sulfúrico (H2SO4) y el ácido perclórico (HClO4).
Ácidos y Bases Débiles: Se ionizan solo parcialmente en solución. La reacción de ionización es reversible, lo que implica que coexisten las formas molecular e iónica, y su comportamiento se describe mediante una constante de equilibrio (Ka para ácidos, Kb para bases). Ejemplos de bases débiles incluyen el amoníaco (NH3) y el ácido acético (CH3COOH) es un ácido débil.

Equilibrio Iónico del Agua y Cuantificación del pH
El agua pura se autoioniza ligeramente, lo que resulta en el producto iónico del agua (Kw).
Kw = [H+][OH–] = 1.0 *10-14 (a 25°C) [37]
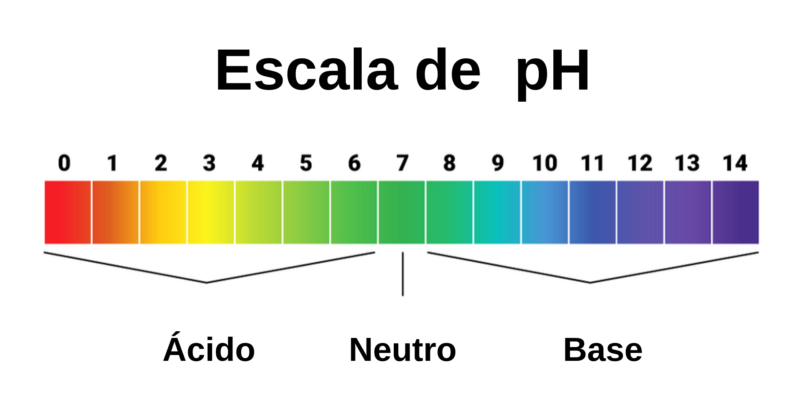
La escala de pH y pOH son medidas logarítmicas de las concentraciones de iones hidrógeno e hidroxilo en una solución acuosa, utilizadas para cuantificar la acidez o basicidad.
Fórmulas de Cuantificación
El pH se define como el logaritmo negativo de la concentración de iones hidrógeno (H+):
pH= -log[H+]
De manera análoga, el pOH se define como:
pOH = -log[OH–]
Existe una relación fundamental que une estas dos escalas en cualquier solución acuosa a 25°C, derivada del producto iónico del agua:
pH + pOH =14
Constantes de Equilibrio (Ka y Kb)
Las constantes de equilibrio ácido (Ka) y base (Kb) son medidas de la fuerza de ionización de las especies débiles. Un ácido con un Ka mayor es más fuerte. Al igual que con el pH, a menudo se utiliza el operador p (p = -log) para obtener pKa y pKb.
Una de las relaciones más importantes en el equilibrio ácido-base es la que conecta la fuerza de un ácido débil con la fuerza de su base conjugada. Para un par conjugado ácido-base, el producto de sus constantes de equilibrio es igual al producto iónico del agua (Kw):
Ka*Kb= Kw
Al aplicar el operador logarítmico, se obtiene la relación inversa:
pKa + pKb= 14
Esta simetría matemática demuestra que la fuerza de un ácido está inversamente relacionada con la fuerza de su base conjugada. Es decir, un ácido débil debe tener una base conjugada relativamente fuerte, y un ácido fuerte (como HCl) debe tener una base conjugada (Cl–) extremadamente débil. Esta relación es una consecuencia directa del equilibrio de autoionización del agua.
