El átomo es la unidad estructural fundamental de la química. Se define como la unidad más pequeña de la materia que aún conserva todas las propiedades químicas de un elemento específico.
Composición Fundamental y Partículas Subatómicas
La estructura atómica se divide en dos componentes principales: el núcleo atómico y la nube electrónica.
El Núcleo Atómico
Ubicado en el centro del átomo, el núcleo concentra casi toda la masa. Está compuesto por protones y neutrones.
Protones: Partículas subatómicas con carga eléctrica positiva (+1). El número de protones en el núcleo define el Número Atómico del elemento, que determina su identidad química. Los protones tienen una masa de aproximadamente 1.007277 unidades de masa atómica (amu).
Neutrones: Partículas sin carga eléctrica (neutras). Aportan masa al núcleo y contribuyen a la estabilidad nuclear. Su masa es ligeramente superior a la del protón.
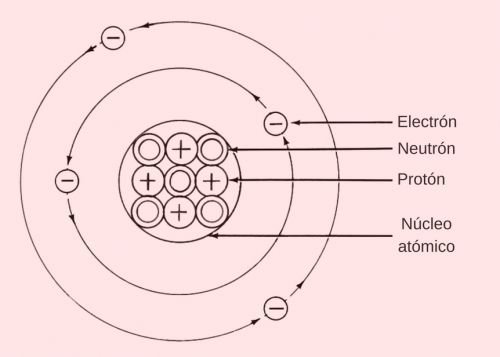
La Nube Electrónica
Es la región más externa del átomo, que rodea al núcleo. Está compuesta por electrones y es la responsable del volumen del átomo y su comportamiento químico.
Electrones: Partículas subatómicas con carga eléctrica negativa (-1). Orbitan alrededor del núcleo y son los portadores de electricidad.Su masa es extremadamente pequeña, aproximadamente 1/1800 veces menor que la de los protones o neutrones, con un valor de 0.000549 amu.
Dada su masa insignificante en comparación con los nucleones, los electrones no se consideran relevantes para el cálculo de la masa atómica. Este principio valida la práctica de que el Número Másico (A) se determine casi exclusivamente por la suma de protones y neutrones en el núcleo, simplificando los cálculos de estequiometría y el análisis de isótopos.

Carga Atómica y Equilibrio Eléctrico
En su estado fundamental, un átomo no tiene carga eléctrica neta; se le considera eléctricamente neutro. Este equilibrio se logra cuando la cantidad de protones positivos en el núcleo se contrarresta exactamente con la cantidad de electrones negativos en la nube electrónica.
Este equilibrio es crucial, ya que cualquier desequilibrio (al ganar o perder electrones) resulta en la formación de iones, que son partículas cargadas. Cuando un átomo pierde esta igualdad, se vuelve energéticamente inestable, y la tendencia a restaurar la estabilidad, generalmente completando la capa de valencia, es el motor principal de la formación de los enlaces químicos.

Evolución de los Modelos Atómicos
La comprensión actual de la estructura atómica se basa en el modelo de la mecánica cuántica, pero su desarrollo ha sido un proceso evolutivo:
Modelo de Dalton (1803): El punto de partida, donde los átomos eran considerados partículas indivisibles e indestructibles, idénticas para cada elemento.
Modelo de Rutherford (1911): Introdujo la noción de que el átomo posee un núcleo denso que concentra la carga positiva, y que los electrones orbitan a grandes distancias.
Modelo de Bohr (1913): Refinó el modelo anterior con postulados que establecían que los electrones solo podían girar en órbitas específicas y cuantificadas sin irradiar energía.
Modelo de la Mecánica Cuántica (1926 – Actual): Este modelo, desarrollado por Schrödinger y otros, sustituye las órbitas definidas por regiones de probabilidad electrónica denominadas orbitales, proporcionando la descripción más precisa de la distribución electrónica que subyace a la configuración electrónica y la organización de la tabla periódica.

