La estequiometría es el estudio de las relaciones cuantitativas entre los reactivos y productos en una reacción química, basándose siempre en una ecuación balanceada. Es el puente entre el mundo microscópico de los átomos y el mundo macroscópico de las masas medibles.

El Concepto de Mol y Masa Molar
El Mol se define como la unidad del Sistema Internacional para la cantidad de sustancia, que contiene el número de Avogadro de entidades elementales. El mol permite relacionar el número de átomos o moléculas con la masa.
La Masa Molar es la masa en gramos de un mol de una sustancia. Este valor es numéricamente equivalente a la masa atómica o molecular, pero expresada en unidades de gramos por mol (g/mol). La masa molar es esencial para convertir entre la masa (medida en el laboratorio) y los moles (la unidad estequiométrica fundamental).

Composición Porcentual
La composición porcentual de un compuesto químico representa el porcentaje en masa de cada uno de sus elementos constituyentes. Es una propiedad intensiva utilizada para la identificación de sustancias.
El cálculo se realiza dividiendo la masa total de un elemento en el compuesto entre la masa molar total del compuesto y multiplicando por 100. La masa molar representa el 100% del compuesto. Por ejemplo, en el NaCl, el porcentaje de Na es (23 g/ 58g)*100% = 39.65%

Determinación de Fórmulas Químicas
A partir de la composición porcentual o datos experimentales de masas, se pueden determinar las fórmulas empíricas y moleculares.
Fórmula Empírica (F.E.): Es la expresión más sencilla de la proporción de átomos en un compuesto. Se determina encontrando la relación de moles más simple entre los elementos constituyentes.
Fórmula Molecular (F.M.): Indica el número real de átomos de cada elemento en una molécula. Si se conoce la masa molar del compuesto, se puede calcular la masa molar de la F.E. y determinar un factor (n) de escala. Multiplicando los subíndices de la F.E. por este factor (n), se obtiene la F.M.

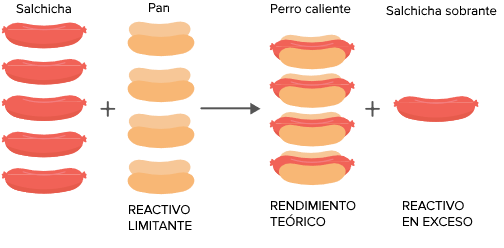
Estequiometría de la Reacción Real: Reactivo Limitante y Rendimiento
Los cálculos estequiométricos de una reacción en el laboratorio o la industria rara vez utilizan cantidades exactas de reactivos. Es necesario considerar qué reactivo se consume primero y cuán eficiente es el proceso.
Metodología para el Reactivo Limitante (R.L.)
El Reactivo Limitante es el reactivo que se consume primero y, por lo tanto, determina la cantidad máxima de producto que se puede formar.
Pasos para la determinación del R.L.:
Cálculo Dual: Se debe calcular la cantidad de producto (en moles o gramos) que se podría obtener si cada reactivo reaccionara completamente. Se realizan cálculos masa-masa o mol-mol usando la relación estequiométrica de la ecuación balanceada.
Identificación: El reactivo que produce la menor cantidad de producto es el Reactivo Limitante. El resto de reactivos están en exceso.
El conocimiento del R.L. permite calcular la masa real de producto formado y, crucialmente, la masa del reactivo en exceso que queda sin reaccionar. En procesos industriales, controlar el R.L. es vital para optimizar la pureza del producto y minimizar los desechos, haciendo que el cálculo de la cantidad sobrante sea un dato de gestión esencial.
Metodología para el Rendimiento Porcentual (R.P.)
El Rendimiento Porcentual mide la eficiencia de una reacción al comparar la cantidad obtenida experimentalmente con la cantidad máxima posible teóricamente.
Rendimiento Teórico: Es la cantidad máxima de producto que se espera, determinada mediante cálculos estequiométricos a partir de la cantidad inicial del Reactivo Limitante.
Rendimiento Real: Es la cantidad de producto que se obtiene realmente en el experimento.
Cálculo del R.P.: Se calcula como la relación entre estos dos valores, multiplicada por 100:
Rendimiento Porcentual= Rendimiento Real / Rendimiento Teórico*100%