La Tabla Periódica es la herramienta central de la química, organizando los elementos en función de su número atómico creciente (Z) y agrupándolos según sus configuraciones electrónicas externas, lo que permite predecir sus propiedades químicas y físicas.

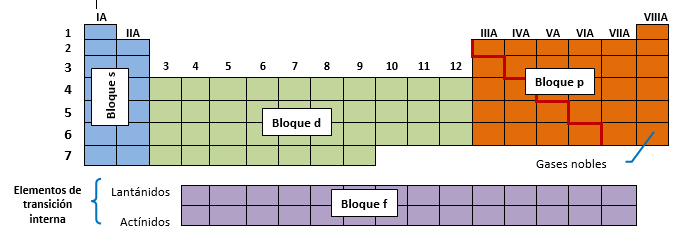
Estructura Fundamental: Grupos y Períodos
Grupos (Columnas): La tabla consta de 18 grupos. Los elementos dentro de un mismo grupo poseen configuraciones de electrones de valencia similares, lo que se traduce en propiedades químicas y reactividades análogas.
Períodos (Filas): Existen 7 períodos. El número de período corresponde al nivel de energía principal (n) más alto que contiene electrones para ese elemento.

Los Bloques de la Tabla Periódica
La división de la tabla en bloques se basa en el tipo de orbital (s, p, d, f) que está siendo llenado por el electrón de valencia de mayor energía (o el último electrón añadido):
Bloque s: Acomoda hasta dos elementos por nivel (dos electrones en el orbital s), incluyendo los grupos 1 y 2.
Bloque p: Acomoda hasta seis elementos por nivel (seis electrones en los orbitales p), incluyendo los grupos 13 al 18.
Bloque d: Acomoda hasta diez elementos por nivel (diez electrones en los orbitales d), constituyendo los metales de transición.
Bloque f: Acomoda hasta catorce elementos por nivel (catorce electrones en los orbitales f), que son los lantánidos y actínidos, generalmente ubicados por separado.
Fundamentos Físicos de las Tendencias Periódicas
Las variaciones predecibles en las propiedades (tendencias periódicas) tienen su origen en la interacción fundamental entre el núcleo positivo y los electrones negativos, descrita por la Ley de Coulomb. Esta ley establece que la fuerza electrostática de atracción (F_e) es directamente proporcional al producto de las cargas (q_1 q_2) e inversamente proporcional al cuadrado de la distancia (r) entre ellas:
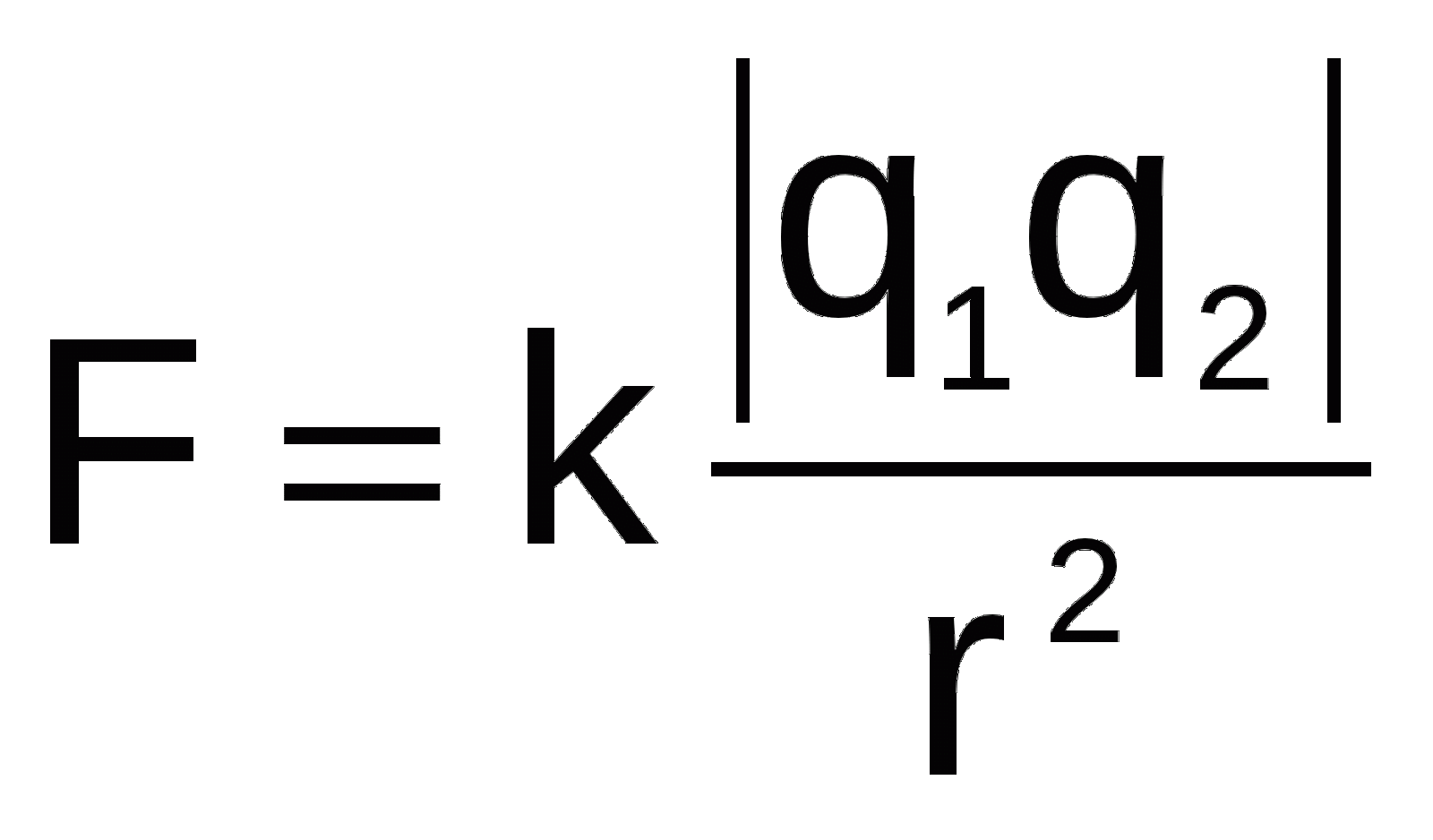
La comprensión de las tendencias requiere enfocarse en dos variables clave que modifican F_e: la distancia (r, relacionada con el número de capas) y la carga nuclear efectiva ( la atracción neta experimentada por los electrones de valencia).
Tendencias Periódicas Fundamentales
Las tendencias periódicas describen cómo cambian las propiedades a lo largo de los grupos (vertical) y períodos (horizontal).
Radio Atómico (R.A.)
Mide el tamaño del átomo.
Tendencia en Grupos (hacia abajo): El R.A. aumenta. Esto se debe a que, a medida que se desciende en un grupo, se añade un nuevo nivel de energía principal, incrementando significativamente la distancia (r) de los electrones de valencia al núcleo.
Tendencia en Períodos (de izquierda a derecha): El R.A. disminuye. Al moverse de izquierda a derecha, los electrones se añaden al mismo nivel energético, pero el número de protones (carga nuclear, Z) aumenta. Este aumento de la carga nuclear positiva no se compensa completamente por el apantallamiento de los electrones en la misma capa. El resultado es un incremento de la Zeff, lo que genera una mayor fuerza de atracción (F_e) sobre la capa de valencia, comprimiendo el átomo y reduciendo su radio.
Energía de Ionización (IE)
Es la energía mínima requerida para remover el electrón más débilmente unido de un átomo gaseoso.
Tendencia General: La IE aumenta de izquierda a derecha en un período y de abajo hacia arriba en un grupo.
Fundamento Causal: Los átomos más pequeños (menor R.A.) tienen sus electrones de valencia más cerca del núcleo. Según la Ley de Coulomb, cuanto menor sea la distancia r, mayor será la fuerza de atracción F_e, por lo que se requiere más energía para vencer esta atracción y extraer el electrón.
Electronegatividad (EN)
Es la capacidad que tiene un átomo para atraer hacia sí mismo los electrones de un enlace químico.
Tendencia General: La EN aumenta de izquierda a derecha en un período y de abajo hacia arriba en un grupo.
Importancia: La electronegatividad es la propiedad periódica más relevante para predecir el comportamiento químico, ya que la diferencia en electronegatividad entre dos átomos determinará el tipo de enlace que se formará.
.png)
