Los estados de agregación de la materia describen cómo las partículas se organizan y mueven en función de la energía cinética interna y las fuerzas intermoleculares. Estos estados representan cambios físicos, donde la identidad química de la sustancia no se altera.
Los Cuatro Estados Fundamentales
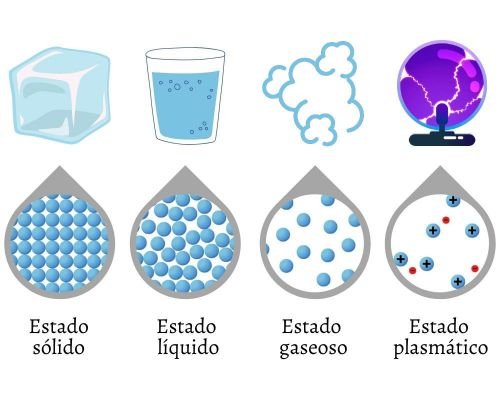
Los estados macroscópicos más comunes son el sólido, el líquido y el gas, a los que se añade el plasma como el cuarto estado.
Sólido (S): Caracterizado por tener una forma y un volumen definidos. Sus partículas están muy cerca unas de otras y su movimiento se limita a la vibración en posiciones fijas.
Líquido (L): Posee un volumen definido, pero carece de forma propia, adoptando la del recipiente. Sus partículas tienen suficiente energía cinética para deslizarse y moverse unas sobre otras.
Gas (G): Carece de forma y volumen definidos, ocupando por completo el contenedor. Las partículas están muy separadas y se mueven caóticamente.
Plasma (P): Es un estado de alta energía, comparable a un gas, pero ionizado. El plasma consiste en una mezcla de electrones libres y núcleos atómicos desnudos (iones), resultante de someter el gas a temperaturas extremadamente altas, induciendo la ionización.
Procesos de Transición de Fase (Cambios Físicos)
Las transiciones de fase son el resultado del intercambio de energía (entalpía) con el entorno. Estas transiciones se clasifican según si requieren la absorción de calor (procesos endotérmicos) o la liberación de calor (procesos exotérmicos).

Procesos Endotérmicos (Absorben Energía)
Estos procesos requieren un aumento de la energía cinética de las partículas para vencer las fuerzas de atracción intermoleculares.
Fusión (S =>L): Ocurre al calentar un sólido, haciendo que las partículas aumenten su movimiento hasta que la estructura rígida se desmorona.
Vaporización (L=>G): Se produce cuando se calienta un líquido, y la materia en estado líquido pasa a estado gaseoso.
Sublimación (S=>G): Es el cambio directo de sólido a gas sin pasar por la fase líquida. Un ejemplo clásico es el hielo seco (dióxido de carbono sólido).
Ionización (G=>P): El proceso que requiere la adición de una cantidad significativa de energía al gas, liberando electrones de los átomos y transformándolo en plasma.

Procesos Exotérmicos (Liberan Energía)
Estos procesos ocurren generalmente por enfriamiento, lo que disminuye la energía cinética de las partículas, permitiendo que las fuerzas de atracción intermoleculares las organicen en un estado de menor energía.
Solidificación (L=>S): Sucede al enfriar un líquido. Las partículas se acercan y su movimiento se reduce, fijándose en posiciones rígidas.
Condensación (G=>L): Ocurre al enfriar un gas, haciendo que las partículas pierdan energía y se agrupen en la fase líquida.
Sublimación Inversa (Deposición) (G=>S): Es el paso directo de gas a sólido.
Desionización (P=>G): El plasma libera energía, y los iones positivos capturan electrones, regresando al estado gaseoso neutro.

El estudio de estas transiciones confirma que el cambio de fase es una manifestación de principios termodinámicos. La energía requerida para ir de un estado a otro es constante, independientemente del camino que se tome. Por ejemplo, la entalpía de sublimación, que es la energía total requerida para ir de sólido a gas en un paso, es aproximadamente igual a la suma de la entalpía de fusión y la entalpía de vaporización. Esta relación es una aplicación de la ley de Hess.
Finalmente, el plasma representa un punto de quiebre en los estados de la materia tradicionales, ya que la ionización implica una ruptura de la estructura atómica al separar las cargas. Este nivel de alta energía demuestra que los cambios de fase se extienden más allá de la reorganización molecular, alcanzando la esfera nuclear/electrónica, lo cual es fundamental en el estudio de fenómenos astrofísicos y tecnológicos avanzados.
